Cục Quản lý dược, Bộ Y tế, vừa ra thông báo ngừng tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với Công ty CP Dược phẩm Me Di Sun. Quyết định này có hiệu lực trong 12 tháng kể từ ngày 30/7.
Quyết định này được đưa ra sau khi Công ty CP Dược phẩm Me Di Sun sản xuất 2 lô thuốc vi phạm chất lượng mức độ 2. Đây là mức độ vi phạm nghiêm trọng, ảnh hưởng trực tiếp đến chất lượng và an toàn của thuốc.
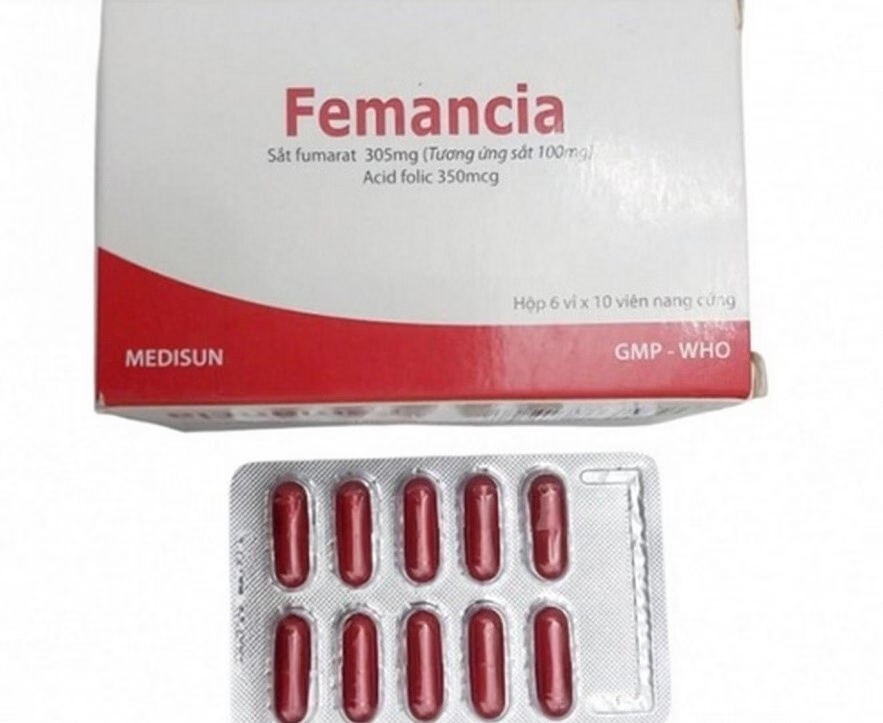
Trước đó, Cục Quản lý dược đã có văn bản thông báo thu hồi bắt buộc toàn bộ các lô thuốc Femancia do công ty này sản xuất. Thuốc Femancia là viên nang cứng chứa sắt nguyên tố và Acid Folic, được chỉ định trong các trường hợp thiếu máu do thiếu sắt hoặc thiếu hụt acid folic.
Việc thu hồi thuốc Femancia được thực hiện theo quy định tại Luật Dược 2016. Công ty CP Dược phẩm Me Di Sun phải phối hợp với nhà phân phối thuốc để tổ chức việc thu hồi toàn bộ thuốc Femancia trong vòng 15 ngày.
Cục Quản lý dược yêu cầu Công ty CP Dược phẩm Me Di Sun phải nghiêm túc chấp hành các quy định của pháp luật về dược và chịu trách nhiệm bảo đảm an toàn cho người bệnh. Đồng thời, công ty này cũng phải thực hiện các biện pháp khắc phục và ngăn chặn tái diễn vi phạm.
Người dân nếu đang sử dụng thuốc Femancia cần kiểm tra lô sản phẩm và ngay lập tức liên hệ với nơi cung cấp hoặc cơ quan y tế gần nhất nếu phát hiện thuốc có dấu hiệu bất thường. Sự an toàn của người bệnh luôn là ưu tiên hàng đầu, và mọi thông tin liên quan đến thuốc sẽ được cập nhật kịp thời.
Công ty CP Dược phẩm Me Di Sun cần tăng cường hệ thống quản lý chất lượng để đảm bảo sản phẩm đạt tiêu chuẩn trước khi lưu hành. Việc ngừng tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc sẽ giúp cơ quan quản lý dược tập trung vào việc kiểm tra và đánh giá lại hệ thống quản lý chất lượng của công ty này.